Einsendungen zur Untersuchung auf Batrachochytrium dendrobatidis & Batrachochytrium salamandrivorans
Hinweise und allgemeine Informationen zum Erreger und Übertragungswegen
Der sogenannte Froschpilz Batrachochytrium dendrobatidis (Bd), allgemein auch oft als Chytridpilz bezeichnet, ist ein Krankheitserreger bei Amphibien, der alle Ordnungen (Froschlurche, Salamander und Molche sowie Blindwühlen) befallen kann. Zu den empfänglichen Spezies zählen auch Axolotl (Ambystoma mexicanum) sowie andere Arten der Gattung Ambystoma.
Daneben ist ein naher Verwandter des Froschpilzes, der sogenannte Salamanderpilz, Batrachochytrium salamandrivorans (Bsal) bekannt. Inzwischen weiß man, dass manche Froscharten auch erkranken können, aber dazu scheint eine sehr hoher Dosis des Erregers notwendig zu sein. Allerdings können sie den Erreger weiterverbreiten und auf empfängliche Schwanzlurche übertragen. Die Infektion mit Bsal ist v.a. für echte Salamander (Familie Salamandridae) potenziell tödlich.
Die Übertragung dieser Erreger erfolgt über sogenannte Zoosporen, einzellige Fortpflanzungsstadien der Chytridpilze, die sich in Wasser selbstständig fortbewegen können. Bei Bsal wurde inzwischen auch eine umweltstabile Dauerform entdeckt. Austrocknung führt zumindest bei Bd zur Abtötung der Zoosporen, jedoch können auch winzige Feuchtigkeitsreste (bspw. an Pflanzen und Einrichtungsgegenständen) die Übertragung des Erregers ermöglichen. Auch nicht empfängliche Amphibien, Wassertiere oder Wasserpflanzen können so zu einer passiven Verbreitung des Erregers beitragen. Die Zoosporen infizieren verhornte (keratinisierte) Hautzellen, in denen sie sich vermehren und aus denen nach einer Wachstumsphase neue Zoosporen freigesetzt werden.
Informationen zur Diagnostik
- Im Hessischen Landeslabor wird die sogenannte real-time PCR angewendet ( PCR Erklärung). Mit Hilfe dieser Methode wird untersucht, ob genetisches Material (DNA) des Erregers in einer Probe vorhanden ist.
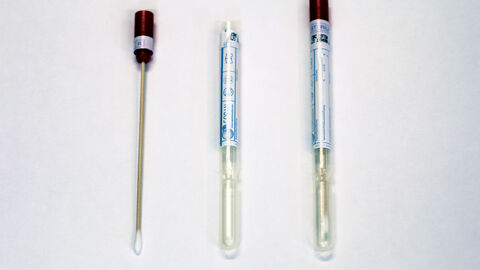
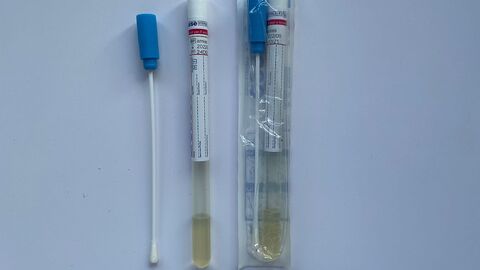
- Für die Probennahme werden sterile Abstrichbestecke empfohlen (Wattetupfer in Kunststoffröhrchen ohne Transportmedium). Sie haben neben der gesicherten Qualität für medizinische Untersuchungen den Vorteil, dass durch die Kunststoffröhre, in die der Tupfer nach der Beprobung zurück gesteckt wird, ein geschützter und hygienischer Transport möglich ist.
- Die Bestellung ist über verschieden Online-Versandhändler möglich (Beispiele s. weiterführende Links).
- Bitte verwenden Sie für Proben, welche zusätzlich kulturell-bakteriologisch/-mykologisch untersucht werden sollen („Hautprofile“) einen zusätzlichen Tupfer mit Transportmedium. Für parasitologische Kotuntersuchungen sollte frischer Kot in einem dicht schließenden Gefäß eingesandt werden.